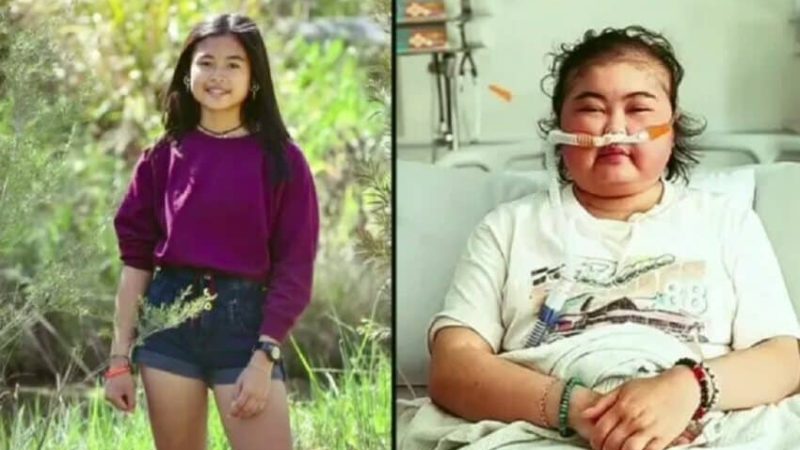
Centri za kontrolu i prevenciju bolesti (CDC) u petak, 20. svibnja, objavili su nove podatke koji pokazuju ukupno 1.268.008 prijava nuspojava povezanih s cjepivima protiv koronavirusa (COVID-19).
Izvješća su dostavljena između 14. prosinca 2020. i 13. svibnja 2022. Sustavu za prijavu nuspojava cjepiva (VAERS), primarnom sustavu za prijavu nuspojava cjepiva u Americi koji financira država.
Unatoč alarmantnom broju slučajeva povezanih s cjepivima protiv koronavirusa, CDC je potpisao treću doza za djecu u dobi od pet do 11 godina.
Podaci VAERS-a pokazuju ukupno 28.141 prijavu smrti, što ukazuje na povećanje od 173 u odnosu na prethodni tjedan; i 230.364 teške ozljede, što je za 1.887 više u odnosu na prethodni tjedan. Ukupno je VAERS-u tijekom prethodnog tjedna prijavljeno 6859 dodatnih nuspojava.
Uz iznimku stranih izvješća VAERS-u, 817.538 nuspojava prijavljeno je u SAD-u između 14. prosinca 2020. i 13. svibnja 2022. Izvješća uključuju 12.961 smrtnih slučajeva i 82.544 teških ozljeda.
Inozemna izvješća odnose se na izvješća koja strane podružnice šalju proizvođačima cjepiva u zemlji. Prema propisima Uprave za hranu i lijekove (FDA), ako je proizvođač obaviješten o stranom izvješću o slučaju koji opisuje događaj koji je i ozbiljan i koji nije dokumentiran na etiketi proizvoda, proizvođač je dužan podnijeti izvješće VAERS-u.
Od 12.961 smrtnog slučaja u SAD-u prijavljenih do 13. svibnja, 16 posto dogodilo se unutar 24 sata od cijepljenja; 20 posto se dogodilo unutar 48 sati od cijepljenja; a 59 posto se dogodilo kod osoba koje su doživjele pojavu simptoma unutar 48 sati nakon cijepljenja cjepivom protiv Covid-19.
Do 13. svibnja u SAD-u je primijenjeno oko 581 milijun doza cjepiva protiv koronavirusa. To uključuje 343 milijuna doza Pfizera, 219 milijuna doza Moderne i 19 milijuna doza Johnson & Johnson (J&J).
Svakog petka VAERS objavljuje izvješća o ozljedama od cjepiva zaprimljena do određenog datuma. Sva izvješća koja se podnose VAERS-u moraju se zatim temeljito istražiti prije nego što se može potvrditi uzročna veza. Međutim, povijesno se pokazalo da VAERS prijavljuje samo jedan posto stvarnih nuspojava cjepiva.
U međuvremenu, podaci VAERS-a za djecu od pet do 11 godina od 13. svibnja otkrili su sljedeće:
- Bilo je 10.745 nuspojava, s 279 slučajeva koji su ocijenjeni kao teški i pet prijavljenih smrtnih slučajeva.
- Zabilježena su 22 izvješća o miokarditisu ili upali srčanog mišića i perikarditisu ili upali vanjske sluznice srca. Tijekom prethodnog tjedna, CDC je uklonio izvješća o miokarditisu i perikarditisu iz VAERS sustava u ovoj dobnoj skupini bez ikakvog objašnjenja.
- Zabilježena su 43 izvješća o poremećajima zgrušavanja krvi.
Savjetodavna komisija CDC-a podržava Pfizerovu dozu za djecu u dobi od 5 do 11 godina
U četvrtak, 19. svibnja, neovisna savjetodavna komisija CDC-a odobrila je treću dozu cjepiva Pfizer-BioNTech COVID-19 za djecu u dobi od pet do 11 godina.
Ravnateljica CDC-a dr. Rochelle Walensky potpisala je preporuku Savjetodavnog odbora za praksu cijepljenja (ACIP). To znači da zdravstveni djelatnici sada mogu početi primjenjivati treću dozu pojačivača za COVID-19.
Preporuka ACIP-a došla je dva dana nakon što je FDA odobrila Pfizerov zahtjev za odobrenje za hitnu upotrebu (EUA) jedne doze za istu dobnu skupinu, nakon tvrdnje da bi treću injekciju trebalo primijeniti najmanje pet mjeseci nakon početne primarne serije od dvije doze Pfizerovog cjepiva.
FDA je odobrila EUA bez sastanka sa svojim savjetodavnim povjerenstvom za cjepivo neovisnih stručnjaka kako bi se raspravljalo o Pfizerovim podacima o djeci u dobi od pet do 11 godina. Umjesto toga, odobrenje se temeljilo na studijskoj podskupini od samo 67 djece koja su pokazala više razine antitijela mjesec dana nakon davanja dodatna doza.
FDA je odobrila EUA bez sastanka sa svojim savjetodavnim povjerenstvom za cjepivo neovisnih stručnjaka kako bi se raspravljalo o Pfizerovim podacima o djeci u dobi od pet do 11 godina. Umjesto toga, odobrenje se temeljilo na studijskoj podskupini od samo 67 djece koja su pokazala više razine antitijela mjesec dana nakon davanja pojačivača. S malom studijskom podskupinom za Pfizer pojačivač, FDA je odobrila EUA za pojačivače, iako podaci ukazuju na veće stope infekcije među potpuno cijepljenom djecom u dobnoj skupini od pet do 11 godina u usporedbi s necijepljenom djecom.
Osim toga, još uvijek nema studija koje bi testirale učinkovitost cjepiva protiv trenutno dominantne varijante BA.2 COVID-19. Postoje i dvije nove studije koje otkrivaju da za cijepljene osobe, koje su zaražene omikron varijantom, zaraza pruža bolju zaštitu od budućih sojeva nego što pruža pojačivač.
FDA je izjavila da nije identificirala nikakve nove sigurnosne probleme i da su djeca u ispitivanju iskusila iste blage nuspojave, kao i druga nakon što su primila dodatnu dozu.
Podskup od samo 67 djece premalen je da bi učinkovito otkrio potencijalne nuspojave poput miokarditisa. Također ostaje za vidjeti kako brzo bilo kakva zaštita nestaje jer sudionici ispitivanja nisu praćeni dulje od 28 dana.